
11874
2
详细信息
一、药品审评中心CDE 简介
国家药品监督管理局(NMPA)下设若干直属单位,其中包括CDE(药品审评中心)、CMDE(医疗器械技术审评中心)和CFDI(药品审核查验中心)等。
药品审评中心(CENTER FOR DRUG EVALUATION,CDE)是国家药品监督管理局药品注册技术审评机构,为药品注册提供技术支持。按照国家药品监督管理局颁布的药品注册管理有关规章,负责组织对药品注册申请进行技术审评。承办国家药品监督管理局交办的其他事项。
二、药品审评中心CDE 官网查询指南
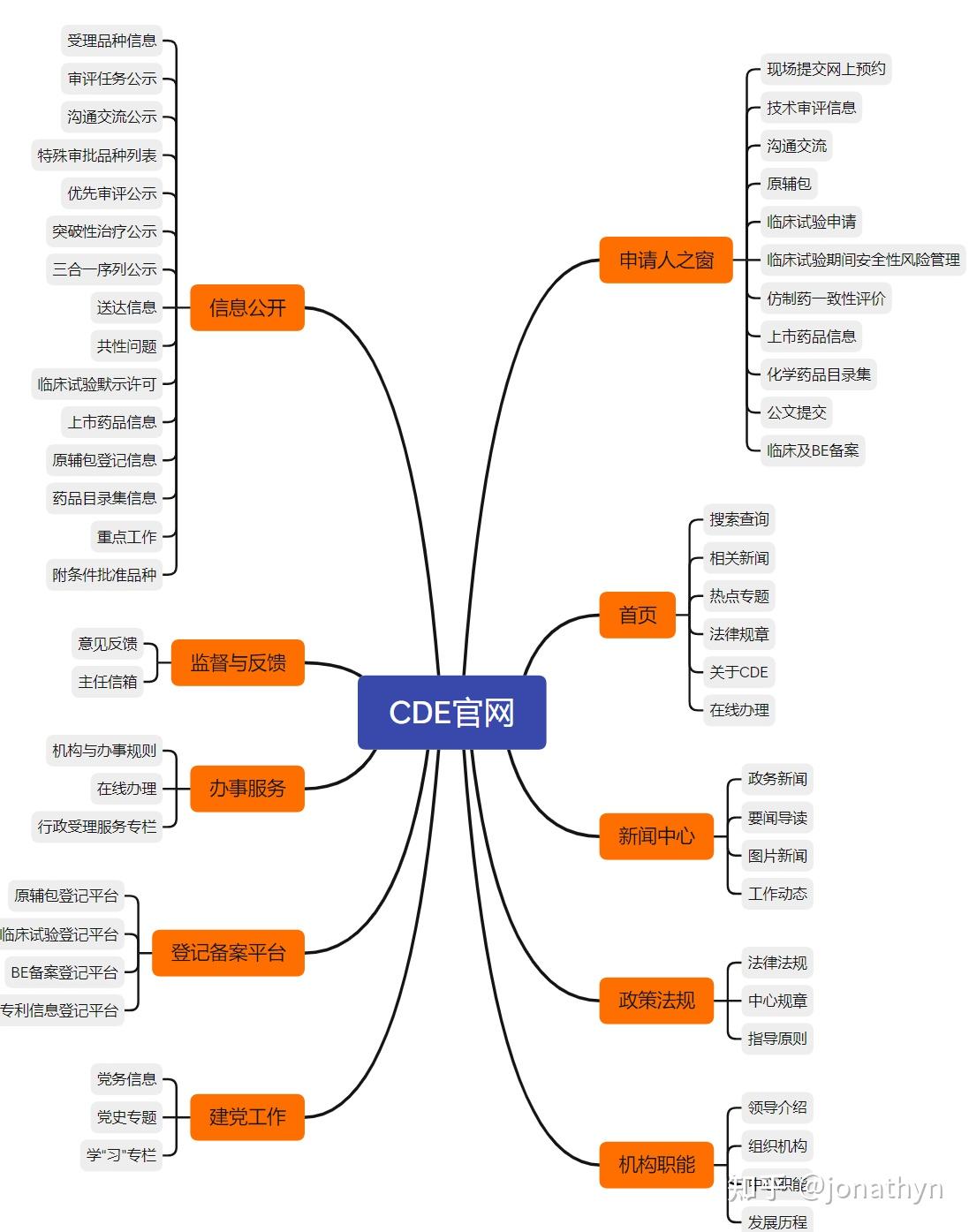
药品审评中心(CDE)官网共有10个栏目构成。
1.首页
药品审评中心官网首页的信息展示,主要是其他栏目中部分信息的汇总,比如药闻导读、中心规章等信息,在官网栏目的”信息中心”和“政策法规”会有显示。
2.新闻中心
新闻中心包含政务要闻、要闻导读、图片新闻、工作动态四大模块。其中,“工作动态”一栏通常会有一些指导原则征求意见稿及正式稿、参比制剂公式、线上培训等内容,可着重关注。
3.政策法规
政策法规中最重要的子栏目是“工作规章”和“指导原则”,这是由CDE制定发布的。中心规章主要侧重CDE审评期间与过程中的工作流程与程序。
4.机构职能
该栏目对药品审评中心领导班子、机构职能、中心职能、发展历程做了简要介绍。
5.申请人之窗
该栏目是企业专属,需要通过ukey才能激活登陆。主要内容包括了账号管理、申报品种一览、进度查询、沟通交流、申报信息完善与提交、电子资料提交、审评报告、发补通知、审评结论等。
6.信息公开
CDE官网信息公开中共有受理品种信息、审评任务公示等9个子栏目,支持上市药品信息、仿制药一致性评价、临床试验默示许可等数据查询。
7.监督与反馈
可通过意见反馈及主任信箱提交建议意见。
8.办事服务
包含机构与办事规则、在线办理、行政受理服务专栏三大模块。其中机构与办事规则下的"办事指南",提供药品注册申请的受理、药品注册申请受理及审评审批进度查询、药品注册申请相关业务咨询、药品注册申请优先审评审批的提出与审批、药品注册申请审批信息公示、药品注册申请信息变更、药品注册申请的主动撤回、药品注册申请批准信息的更正、药审中心公文办理、药物临床试验期间安全信息报告与整理等业务服务。
9.登记备案平台
本模块涵盖了三个登记平台(四个分模块,其中,临床试验和BE备案共用一个登记平台,统称为“药物临床试验登记与信息公示平台”),其中专利信息登记平台的相关内容已经在首页的热点栏目中进行详述。原辅包登记平台需要通过申请人之窗进行登陆;药物临床试验登记与信息公示平台既可以通过申请人之窗登陆,也可以通过旧系统的账号进行登陆;专利信息登记平台则需要注册“中国上市药品专利信息登记平台用户登录”账号,通过账号密码进行登陆。
10.党建工作
相关党务信息、党建学习。
随机推荐
最新推荐
